超分辨率光学成像
超分辨光学成像(Super-resolution Optical Microscopy)特指分辨率打破了光学显微镜分辨率极限(200nm)的显微镜,技术原理主要有受激发射损耗显微镜技术和光激活定位显微镜技术。
光学显微镜的分辨率
阿贝极限
19世纪末,德国物理学家恩斯特·阿贝指出:光学显微镜分辨率的极限,大约是可见光波长的一半。可见光中波长最短的是蓝紫光,其波长在0.4微米左右。因此,如果两点之间的距离小于0.2微米,我们将无法分辨出这是两个点。这就是通常所说的“阿贝极限”。阿贝极限使我们无法更加深入地了解微观世界,例如病毒的直径通常就在0.02~0.3微米,无法用已有的光学显微镜观察清楚。
$d= \lambda /2 n sin \theta $
1873年,德国物理学家恩斯特·阿贝(Ernst Abbe)提出,光学显微镜受限于光的衍射效应和光学系统的有限孔径,存在分辨率极限(也称阿贝极限),其数值约为$l / 2NA$(分辨率极限公式),其中l是光波波长,NA是光学系统的数值孔径(Numerical Aperture)
其中,$NA=n \sin \theta$ , n为介质的折射率,a为物镜孔径角的一半。成像时若使用波长为400 nm的光,并采用空气(折射率为1)作为物镜和样本之间的介质,可计算得到分辨率极限为200 nm。因此,我们通常说,光学显微镜的分辨率极限约为200 nm。
成像分辨率与点扩散函数
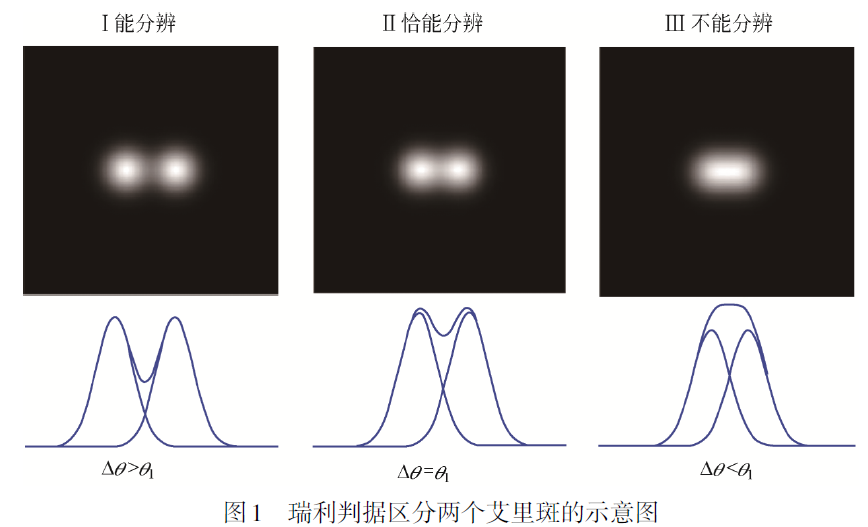
一个点光源通过光学透镜成像输出像的光场强度分布,在图像上观察到一个扩散的光斑,其强度分布曲线称为系统的响应函数或点扩散函数(point spread function,PSF)。光学显微镜成像分辨率定义为可以刚好清晰分辨出两个亮度相同点光源中心之间的最小距离,而显微成像分辨率的极限由光的衍射特征所决定,在宽场显微镜与激光共聚焦显微镜成像系统中,点光源经过不同透镜或物镜后会在焦平面上形成模糊的光斑,称为艾里斑(Airy disc),由艾里在1835年提出计算圆形光斑的衍射极限方法,光斑的强度从中心到边缘按照高斯分布,测定其分布曲线半高宽(full-width at halfmaximum,FWHM) 则为其分辨率,根据式$d_{min} = 0.61λ/NA $计算成像分辨率。
当两个物点由远及近靠近的过程中,通过透镜形成的两个艾里斑会逐渐重叠在一起,两个点的像从可以清晰区分到逐渐变得不易分辨,当刚好能区分开两点的距离称为光学系统的成像分辨极限,1874年瑞利提出当一个艾里斑的中心与另一个艾里斑的第一级暗环重叠时,刚好能分辨出是两个点像时称为瑞利判据。
提高光学显微镜分辨率的途径
为了提高光学显微镜的分辨率,早期的工作往往集中在如何减小艾里斑的尺寸,包括减小光的波长、增大数值孔径。对于前者,直接导致了各种电子显微镜的诞生—采用波长为纳米甚至亚纳米级的电子束进行成像,其分辨率可达纳米量级甚至更小。对于后者,一方面可以更高折射率的成像介质,例如,将空气换为水(折射率为1.333),采用400 nm的光进行成像,极限分辨率可高达150 nm。另一方面,可以利用结构更为复杂的光学收集系统(如共轭双物镜)来增加光学显微镜的有效孔径角,从而提高光学显微镜相对较差的轴向分辨率,其典型代表为4Pi显微镜。此外,还可以使用共焦小孔等来限制艾里斑的尺寸并消除杂散光,从而提高光学显微镜的横向和纵向分辨率,其典型代表是共聚焦显微镜(Confocal Microscope)。
值得指出的是,这里所述的光学显微镜指的是远场光学显微镜(Far-field Optical Microscope),物镜和样本之间的距离远大于光的波长。进一步的研究表明,远场光学显微镜存在分辨率极限的主要原因在于远场一般只能收集传导波信号,而携带了高频信息的倏逝波(Evanescent Wave),其电场强度随传播距离的增加而呈指数衰减。因此,若使用距样本表面仅几个纳米的探针收集并探测近场光信号,可以大幅提高光学显微镜的分辨率,这种思路导致了近场扫描光学显微镜(Near-field Scanning Optical Microscope, NSOM)的诞生,其分辨率可以优于25 nm。而基于倏逝场扫描成像的光学显微镜,通常被称为近场光学显微镜(Near-field Optical Microscope)。
超分辨光学成像技术
超分辨光学成像技术通常指的是基于远场光学显微镜的超分辨成像技术,主要包括两种实现途径:一种是以STED和SIM为代表的“基于点扩散函数修饰”和“结构光照明”。另一种是以STORM/PALM为代表的“基于单分子荧光定位”的超分辨技术。
基于点扩散函数空间调制技术即是通过光学方法缩小激发光斑面积;SIM通过2~3个激发光干涉获得的典型正弦函数模式照明光,使用这种模式化的激发光照射样品获得高频的空间信息;基于单分子定位的随机光学重构成像技术,主要利用绿色荧光蛋白质或有机荧光小分子将生物目标进行共价标记后,在激光照射下产生光激活定位成像(photoactivation localization microscopy) 或在强激光的照射下发生随机光学闪烁,根据随机闪烁信号进行定位,将数千帧图进行叠加重构获得超分辨成像图[(direct) stochastically optical reconstruction microscopy,STORM/dSTORM]。
与后两种成像方法相比,基于点扩散函数空间调制的超分辨成像主要是通过激光照射调控荧光染料在其荧光发射态与非辐射态之间变化实现超分辨成像的方法,其中受激辐射损耗超分辨成像技术(STED) 是基于激光
激发调控荧光探针的光物理发射过程实现高分辨成像的方法。
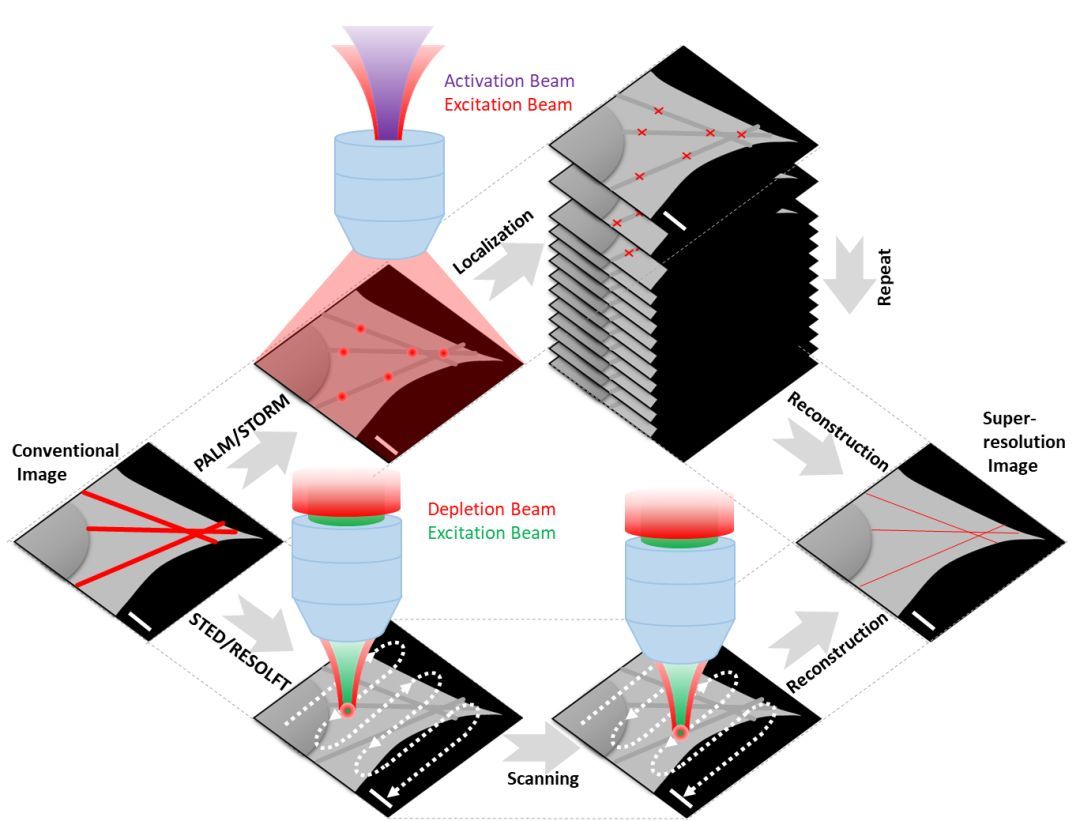
第一大类中,STED及其衍生RESOLFT都是利用“甜甜圈”状的空心光束来修饰位于中间激发光的PSF,从而达到直接超分辨成像的目的。不同的是STED利用了荧光染料分子的“受激辐射损耗”性质,RESOLFT利用了荧光蛋白的“光控可逆转化”(photo-reversible)性质。而(s)SIM则是利用了包含样本的结构信息的干涉图案“摩尔条纹”照明方式,加上后期的图像重构,达到超分辨成像的目的,此外,通过引入非线性光学,NL-SIM可以达到更高的分辨率。
第二大类中,STORM和PALM都是利用了荧光染料分子“光控开关”(photo-switchable)或者荧光蛋白的“光控转化”(photo-convertible)性质,达到在一个衍射极限空间内(200~300 nm)随机“点亮”单个荧光分子并进行高精度定位的目的。类似地,PAINT技术利用了对化学反应常数的精确调控,从而达到类似的“点亮”效果(带有荧光标记的分子和靶向分子之间的短暂结合)。
除上述两大类之外,新兴的MINFLUX技术综合了两类成像技术的优点,将定位精度提高到了前所未有的1纳米;膨胀显微技术ExM通过直接将被成像样品进行物理膨胀的手段,间接达到超分辨成像的目的。此外,还有基于荧光信号的涨落,如闪烁(blinking)和漂白(bleaching)的SOFI和3B技术,他们的出现进一步丰富了超高分辨率显微技术的选择和应用。感兴趣的读者可以从下面三篇综述文章中获取更多信息【4-6】。
STED
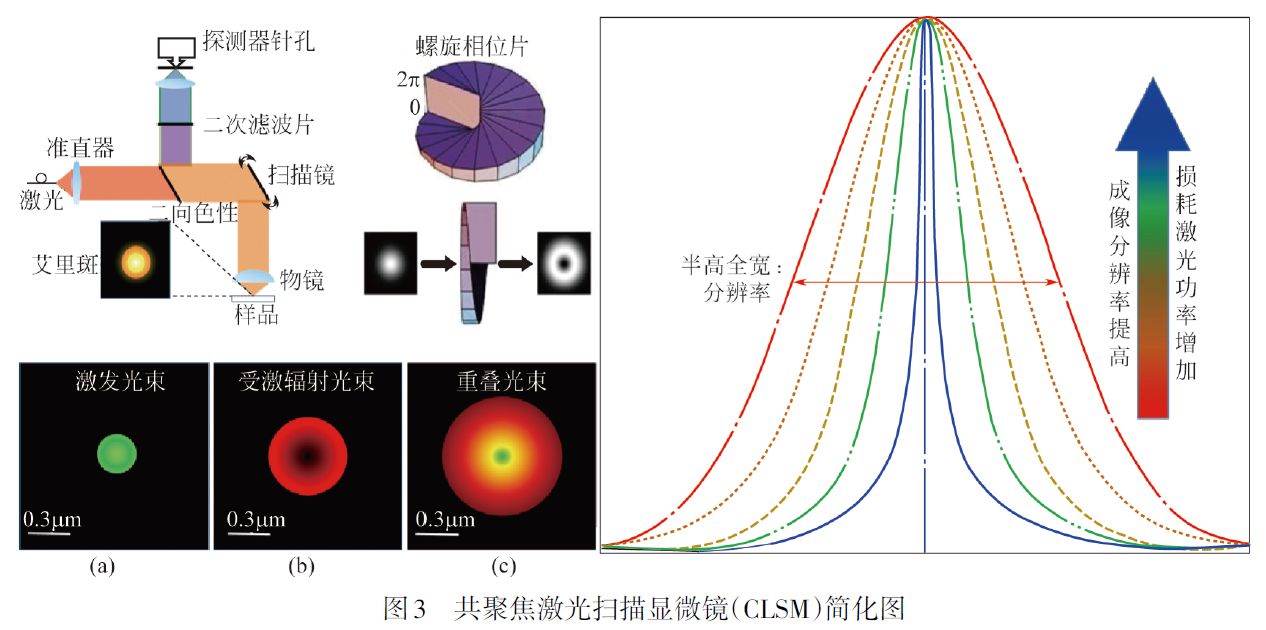
激发射损耗显微镜技术(Stimulated Emission Depletion Microscopy, 简称STED),该成像理论来源于爱因斯坦的受激辐射理论,德国科学家斯蒂芬·赫尔(Stefan W. Hell)创造性地利用受激辐射来抑制自发荧光辐射,最终实现了受激发射损耗显微镜技术(STED)。一个典型的STED显微镜需要两束严格共轴的激光,其中一束为激发光,另外一束为损耗光(也称STED光)。利用激发光使艾里斑范围内的荧光分子被激发,其电子从基态跃迁到激发态。随后,使用甜甜圈型(Doughnut,跟救生圈形状类似)的损耗光照射样品,使得处于激发光斑外围的激发态分子以受激辐射的方式释放能量回到基态,而位于激发光斑内部区域的激发态分子则不受损耗光的影响,继续以自发荧光的方式回到基态。这种照明方式的组合,将荧光发射区域限制在小于艾里斑的区域内,获得了一个小于衍射极限的荧光发光点。最后,通过在二维(或三维)空间内扫描共轴的激发光和损耗光,获得一幅二维(或三维)超分辨图像。1994年,斯蒂芬·赫尔等人提出了STED显微镜的理论。2000年,斯蒂芬·赫尔研究组通过生物实验证实了STED显微镜的超分辨成像能力。
自发辐射与受激辐射
荧光是一种光致冷发光现象,荧光分子吸收一个短波长光子受到激发后跃迁至激发态,在激发态短暂停留,发生一些弛豫到最低激发态后,从激发态自发辐射回到基态,并发射一个长波长的光子,该长波长的光子即为荧光。如果荧光分子处于激发态,尚未来得及向基态跃迁发射光子,受到外界第二个光子微扰,第二个
光子的能量刚好满足荧光团基态与激发态能级差,则荧光团吸收第二个光子,自发辐射受到抑制,发生受激辐射,此时荧光团会发射两个光子,与吸收的第二光子具有相同能量、频率、相位及传播方向。这样可以精确地控制受激辐射效应产生光子的波长,该波长不同于自发辐射产生的荧光信号的波长。为了避免探针在损耗光处因再吸收产生二次发射而发生干扰,因此耗尽光的波长一般选在发射光谱的尾部,在检测器的前面选择一个低通滤波器阻挡耗尽波长,允许大部分荧光通过,使得经过受激辐射的荧光团有效地变到“暗态”,可以保证其输出光子不能通过滤光片,不会检测到受激辐射的荧光信号,PSF尺寸缩小,提高
分辨率,耗尽的荧光团的暗度或耗尽效率非线性地取决于耗尽激光的局部强度。这类成像方法的最大优点是一种纯光学调控的方法,不需要辅助于数学计算或图像后处理。基本思想是对空间点扩散函数(PSF) 进行工程优化设计,该方法中需要使用两束激光,除了作为激发荧光团的激光束之外,环形的损耗激光束通过受激辐射去激励耗尽激发光斑外围荧光分子发光,仅留下来衍射受限中心的自发荧光,采集该荧光信号,即可获得超分辨成像。
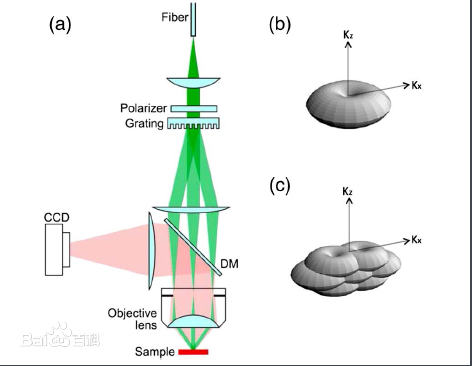
STED显微镜是建立在共聚焦显微镜基础上,采用两个激光器,其中一个充当激发光源,另一个激光器用作损耗光光源,该光源是产生的激光束通过螺旋相位板后变为中空的激光光束,两束光经过准直叠加后照射到样品上,激发光源导致样品产生自发荧光,而损耗光束所照射区域的荧光分子将发生受激辐射,二者共同作用的结果是产生缩小的自发辐射光斑,即为STED超分辨成像。
SIM
结构光照明荧光显微镜是基于常规[荧光显微镜],通过对其[照明方式]的改进,以特定[结构光]成像,从现突破[衍射极限],获得高分辨率样品信息,进而由[傅里叶变换]获得样品显微图像的一种[光学显微镜]。
普通光学显微镜的成像过程可以通过[点扩展函数]进行描述,通过对点扩展函数进行傅里叶变换,可获得显微系统的[光学传递函数]。由于[衍射极限]的存在,光学传递函数限制了通过显微系统的信息量,只允许低频信息通过系统,滤除代表细节的高频信息,即限制了系统的分辨率。
结构光照明显微镜实现超分辨的原理,就是利用特定结构的照明光 在成像过程把位于光学传递函数范围外的一部分信息转移到范围内,利用特定算法将范围内的高频信息移动到原始位置,从而扩展通过显微系统的样品频域信息,使得重构图像的分辨率超越衍射极限的限制。
对于光学显微镜系统,光学传递函数的三维结构是圆环结构,在零频位置存在凹陷。凹陷带来的后果就是CCD 上记录的信息不仅包含物镜焦平面上的样品信息,同时包含焦平面外的样品信息。由于受到焦平面外的信息的干扰,常规荧光显微镜无法获得层析图像。三维结构光照明显微镜提高分辨率、获得层析图像的原理,就是利用特定结构的照明光来获得样品的高频信息,采用特定算法在横向和纵向上扩展样品频域信息的同时弥补凹陷带来的影响。
PALM
光激活定位显微镜技术(Photoactivation Localization Microscopy, 简称PALM)。阿贝极限指出,在远场无法分辨相距$l / 2NA$的两个荧光分子所成的像,但是并没有对单个荧光分子的中心位置确定精度进行限制。如果在艾里斑内仅有一个分子在发射荧光, 我们可以利用单分子定位算法并结合光学系统艾里斑的形状,以超高精度(纳米量级)获得荧光分子的中心位置。倘若将这个单分子定位思想用于实现超分辨成像,其关键在于如何在一个艾里斑内区分多个荧光分子。
为了克服一个艾里斑内只允许一个分子发射荧光的限制,1995年美国科学家埃里克·白兹格(Eric Betzig)通过理论分析,提出可以利用光谱特性对艾里斑内的发射波长不同的荧光分子进行分时探测和中心位置定位,从而实现荧光密集标记样本的超分辨成像。2006年, 埃里克·白兹格等人利用光激活绿色荧光蛋白(PA-GFP)的可控荧光开关特性,结合单分子定位算法,实现了生物样本的超分辨成像。他们首先利用低能量的 405 nm 激光(激活光)来稀疏活化PA-GFP,再使用 561 nm激光(激发光)对活化后的PA-GFP进行单分子荧光成像,直至活化后的PA-GFP分子被光漂白。重复激活-激发-定位-漂白过程,可以在艾里斑内高精度找到大量PA-GFP分子的中心位置,从而重建出一幅由PA-GFP分子中心位置组成的超分辨图像。这种技术被称为光激活定位显微镜(Photoactivation Localization Microscopy, 简称PALM)。
STORM
随机光学重建显微法(stochastic optical reconstruction microscopy,STORM) 是一种将荧光光谱和显微分析技术应用于单个分子之上的崭新的物理手段,其是一种比传统光学显微镜高10倍以上分辨率的新型显微技术。
2006年,哈佛大学的庄小威小组提出了随机光学重建显微镜(Stochastic Optical Reconstruction Microscopy,简称STORM),其成像原理与 PALM 类似,但是在密集标记样本内实现荧光发射稀疏化的方案有所不同。
利用可光转化荧光分子的开关,对其准确定位,然后重建荧光图像。STROM成像过程包含一系列图像循环。每个循环中,只打开视野下一部分荧光基团,这样每个活跃的荧光集团都被分辨,它们的图像与其他分子分开,不重叠。这样确定了基团的准确位置,多次重复这个过程,每次随机打开荧光基团的不同亚基,得到图像,确定每个亚基的位置后,把以上图像重建成清晰的整个图像。以下的例子中,研究者们获得20nm左右的分辨率。
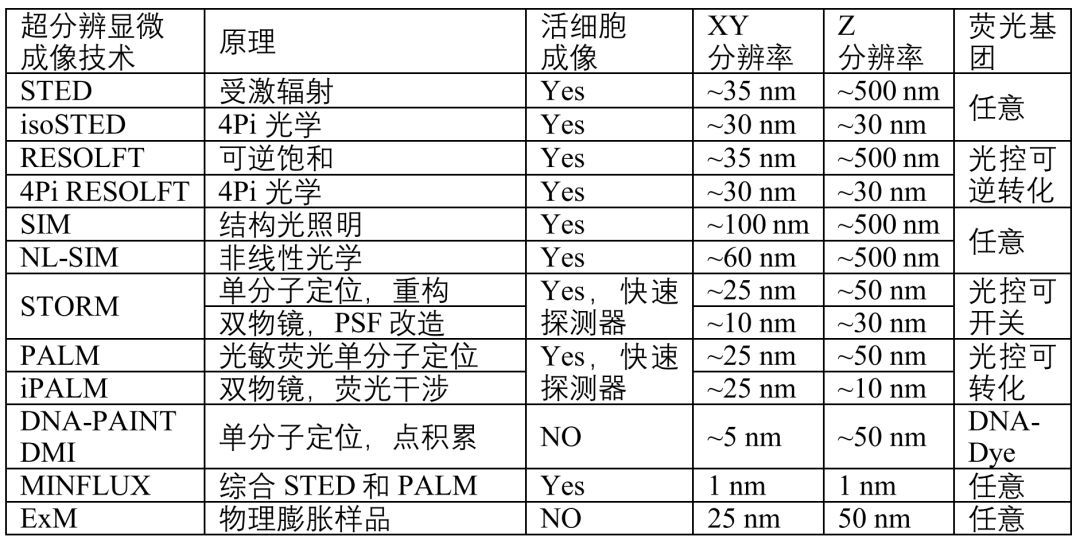
下表简单总结了几种主流超分辨技术的原理、三维成像能力、分辨率和荧光基团要求。对于较厚的生物样品,为了解决散射的问题,近些年发展的适应光学系统(Adaptive Optics, AO),光片照明技术(Light-Sheet Illumination),组织透明化处理(Tissue Clearing)和物理切片等技术方法也取得了可喜的成果。